流式細胞術在以細胞凋亡為策略篩選抗腫瘤藥物中的應用
全球腫瘤發病率持續上升,腫瘤方面的疾病已經成為影響人類健康的主要殺手之一。尋找合適的抗腫瘤藥物已經成為人類對抗腫瘤的一種主要方法。
抗腫瘤藥物篩選策略
抗腫瘤藥物的篩選方法有多種,如細胞凋亡策略、誘導細胞分化、抑制血管生成等。以細胞凋亡為策略篩選腫瘤藥物是眾多方法中的一個主要方向。策略進行抗腫瘤藥物篩選原理、分類
細胞凋亡也稱細胞程序性死亡,是細胞受基因調控的一種主動性的、高度有序的自我消亡的過程。當某些因素破壞或抑制了凋亡途徑,使凋亡過程發生障礙,使本該凋亡的細胞繼續生存和增殖,最終導致形成腫瘤。以細胞凋亡為策略篩選腫瘤藥物就是期望用篩選出的藥物通過重啟腫瘤細胞凋亡通路,使腫瘤細胞發生凋亡,從而達到治療腫瘤疾病的目的。
以細胞凋亡為策略進行抗腫瘤藥物篩選又可以分為動物水平(體內)和細胞水平(體外)。在動物水平又分為CDX模型(腫瘤細胞系移植)、PDX模型(腫瘤組織移植)等,通過給藥后進行藥效評價來篩選出合適的藥物。毫無疑問,動物水平的藥物篩選是必須要做的。然而動物水平實驗要花費的經費、周期以及精力都是巨大的,不通過體外實驗就直接進行體內實驗是具有相當大的風險的。體外實驗周期短、見效快、花費低、風險也更低,不僅能為體內實驗做前期探索,并且體外實驗還能研究藥物發生作用的分子機理。無疑,在體內實驗進行前先做細胞水平(體外)實驗是非常不錯的研究策略。(PS:本公司也精于CDX、PDX模型哦!詳情可點擊小鼠成瘤腫瘤模型、相關經驗-異種移植模型了解。)
三、流式細胞術在以細胞凋亡為策略篩選抗腫瘤藥物中的應用
以細胞凋亡為策略的細胞水平上藥物篩選方法包括:細胞增殖檢測、細胞凋亡檢測等,并且幾種方法常聯用。細胞增殖檢測方法常用MTT或CCK8進行,具體實驗方法可參見本公司另一篇公眾號《細胞毒性之CCK8實驗》。這里主要介紹細胞凋亡檢測,以及流式細胞術在細胞凋亡檢測中的應用(流式細胞術相關知識請點擊流式細胞術—相見恨晚了解)。
凋亡細胞在形態學和生化上有明顯的特征,如細胞皺縮、核固縮、細胞膜卷曲、DNA片段化、線粒體電位發生變化等。因此根據這些特征,流式細胞術有多種方法能定性及定量的檢測細胞凋亡情況。如Annexin V和PI雙染法、TUNEL法檢測細胞凋亡、線粒體膜電位法等等。
四、重點介紹Annexin V和PI雙染法檢測細胞凋亡
其原理是:正常細胞膜是不對稱性的,胞漿面含有帶負電的磷脂(如磷脂酰絲氨酸, PS)。早期凋亡時,細胞表面不對稱性發生改變,PS外翻到胞外側。
Annexin V是一種Ca2+依賴性的對PS有高度親和力的磷脂結合蛋白,可作為探針識別膜表面是否有PS,從而識別凋亡細胞。
PI常用于鑒別死細胞。凋亡細胞的細胞膜仍然是完整的,所以PI不能進入早期凋亡細胞核內。Annexin V和PI雙染法無疑是在細胞水平檢測凋亡的最優先的選擇。
用待篩選的藥物及溶劑對照分別處理目的細胞一段時間,如24h、48h或72h,再用Annexin V和PI雙染法檢測細胞凋亡。這個實驗所需試劑皆已商品化,具體操作流程可按照試劑說明進行。但需要注意的地方有三點:一是需要確定待測藥物所能起最佳作用的細胞。一種藥物不一定對所有類型的腫瘤都有作用,即便有作用,對不同腫瘤作用的大小也不一樣。因此找到最適合待測藥物起作用的腫瘤以及該腫瘤所對應的細胞系是非常關鍵的。常用的方法包括查閱資料、生物信息學(或網絡藥理學)方法、大范圍篩選(分別用待測藥物檢測數種細胞系)等。二是待測藥物作用的時間(不能太短,亦不能太長)。三是藥物的劑量(濃度不能太低,亦不能太高)。并且以上三點亦可以作為體內實驗的前期探索。
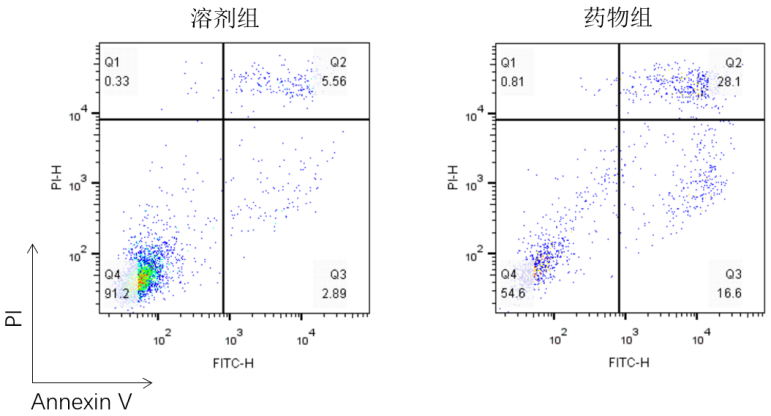
圖1:某濃度藥物處理某細胞X小時后流式檢測細胞凋亡
當流式檢測完成后用流式分析軟件,以全陰性和Annexin V單染、PI單染為對照畫門,從而得出如圖1類型的圖。從圖中可看出,與溶劑組相比,當用藥物處理細胞后,早期凋亡(右下象限)和晚期凋亡(右上象限)細胞占比增加。說明此藥物能夠誘導該細胞凋亡。當然,是否是最佳劑量及時間還需要做梯度實驗。
Annexin V和PI雙染后流式檢測細胞凋亡的方法已廣泛用于抗腫瘤藥物研究。Namrata Karki等此方法檢測了不同濃度的胡桃醌(Juglone)對MIA-PACA-2細胞(人胰腺癌細胞)凋亡的影響(圖2,Namrata Karkia et al. Cytotoxicity of juglone and thymoquinone against pancreatic Cancer cells. Chem Biol Interact. 2020 August 25; 327: 109142)。發現隨著胡桃醌濃度增加,MIA-PACA-2細胞總凋亡率也在增加,尤其是晚凋細胞增加最為明顯。
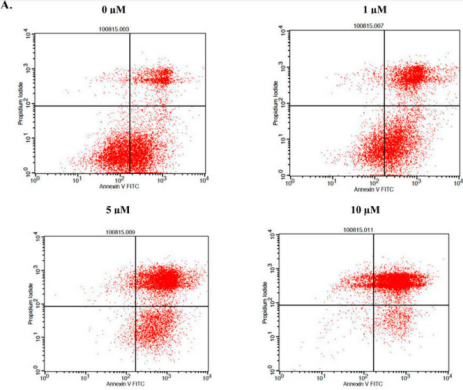
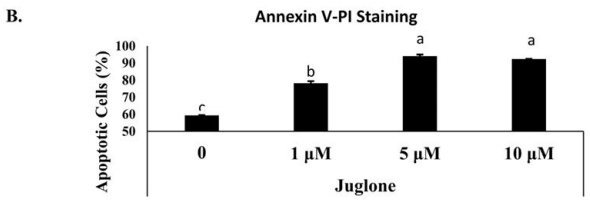
圖2:胡桃醌誘導MIA-PACA-2細胞凋亡
Qinwan Huang等用此方法研究了羌活醇(Notopterol)對HL-60細胞(人急性髓細胞白血病細胞)的影響(圖3,Qinwan Huang et al. Notopterol-induced apoptosis and differentiation in human acute myeloid leukemia HL-60 cells,Drug Design. Development and Therapy 2019:13 1927–1940)。發現羌活醇能夠促進HL-60細胞凋亡,并具有劑量依賴性。
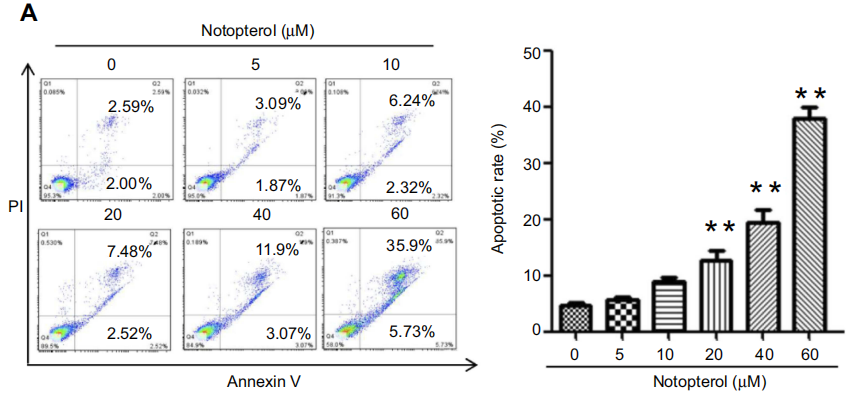
圖3:羌活醇誘導HL-60細胞凋亡
Chenglu Zhu等用Annexin V和PI雙染法發現天花粉蛋白(trichosanthin, TCS)能誘導Hela細胞(人宮頸癌細胞)和Caski細胞(人宮頸癌細胞)凋亡,尤其是早期凋亡增加最為明顯(圖4,Chenglu Zhu et al. Trichosanthin inhibits cervical cancer by regulating oxidative stress-induced apoptosis. BIOENGINEERED. 2021, VOL. 12, NO. 1, 2779–2790)。
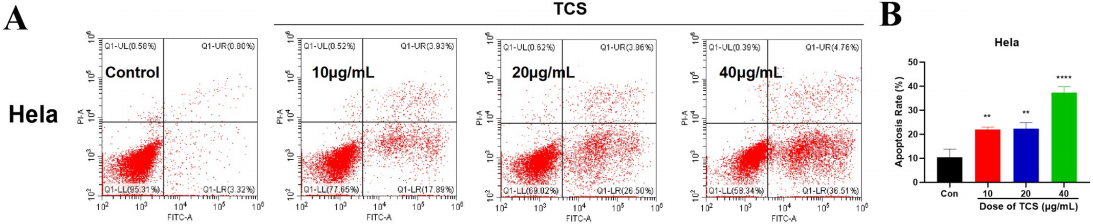
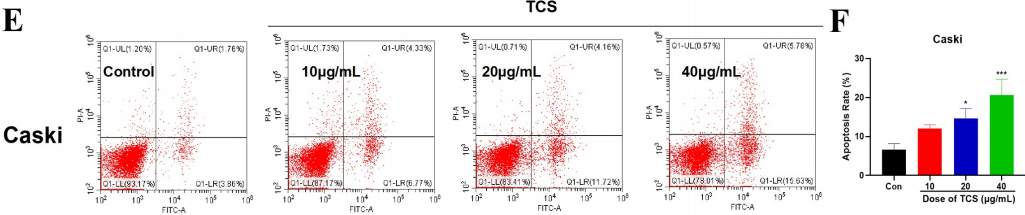
圖4:天花粉蛋白誘導Hela和Caski細胞凋亡
此外,TUNEL法和線粒體膜電位法亦常用于檢測細胞凋亡。因為細胞也會有熒光發生,故可用熒光顯微鏡和流式細胞儀來檢測,更多詳情請咨詢拓普生物!


