【拓普課堂】淺談動物模型與腸道微生物
腸道微生物(Gutmicrobiome)是生活在人類和其他動物消化腸道中的微生物群的所有基因組的總和[1]。腸道菌群在宿主的生存、健康和疾病中起了重要作用[2]。早在中醫經典著作《黃帝內經》中就已提出腸胃對于人體的重要,李東垣深得《內經》之要,在《脾胃論》里指出“內傷脾胃,百病由生”。可見,腸菌對人體健康具有重要影響。隨著現代對腸道菌群的研究,發現腸道菌群可直接參與宿主的神經調節、脂肪代謝、免疫調節等諸多方面。
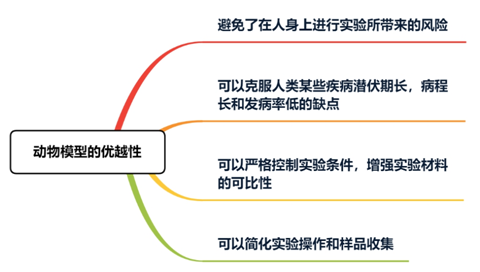
動物模型
以動物建模有助于進行復雜的生物機制研究,且隨著現代分子生物技術的蓬勃發展,高通量測序(Next-generation sequencing technology,NGS)技術的問世,使得腸道微生物的研究進入一個新的研究階段。利用NGS技術獲得龐大的數據信息,通過生物信息學手段,分析腸道微生物的多樣性。利用統計分析,對大量數據進行多樣性分析,比較給藥前后腸道中主要菌群的差異性,解釋藥物可能的作用機制。對揭示腸道微生物對宿主的調節機制具有重要意義。
腸道微生物
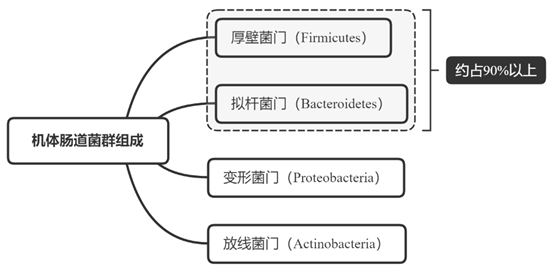
腸道菌群是寄居于宿主,并有益于宿主的一類微生物。腸道菌群在宿主體內有利于宿主方面的物質流動(參與碳水化合物代謝、參與脂肪代謝以及參與蛋白質代謝等)、能量流動(腸道內菌群的動力,是維持腸道微生態和生命活動的基礎,并保持腸道菌群與宿主始終保持著能量交換和轉運的關系。)以及基因流動(在腸道微生態中常常借助噬菌體和質粒在腸道微生物群中發生的基因交互)。
動物模型與腸道微生物相互作用研究
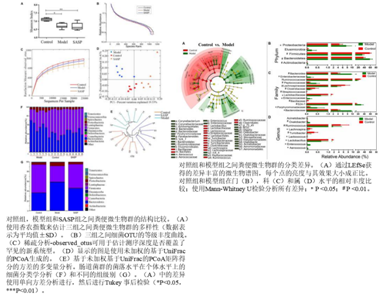
一、炎癥性腸病 (inflammatory bowel disease,IBD)
IBD模型通常是用2,4,6-三硝基苯磺酸(TNBS)聯合乙醇灌腸致炎法,Haihui Zheng[3]等人通過對照組(用乙醇+鹽水處理),模型組(用TNBS-乙醇+鹽水處理)和SASP組(用TNBS-乙醇+SASP處理)研究腸道菌群的影響機制。研究基于分類學分析結果發現,模型組的Firmicutes比例降低,Proteobacteria和Bacteroidetes升高。給藥治療后(SASP組)可以增加Firmicutes的水平,降低Proteobacteria和Bacteroidetes的水平,從而將實驗性結腸炎大鼠的腸道組成調節至與對照組相似的水平。
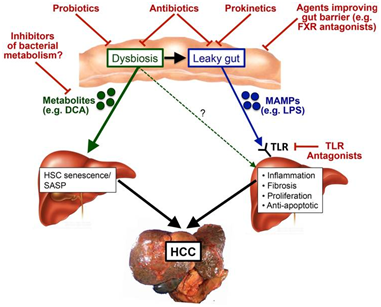
二、腫瘤疾病
在DEN誘發肝癌的大鼠模型中,利用含有Streptococcus thermophiles,Bifidobacteriumbreve,Bifidobacterium longum,Bifidobacterium infantis,Lactobacillus acidophilus,Lactobacillus plantarum,Lactobacillus paracasei的制劑可以減輕腸生態失調,改善腸道炎癥和肝腫瘤生長和多樣性降低[4]。在皮下移植小鼠模型中,益生菌混合物Prohep(包含Lactobacillus rhamnosusGG,Escherichia coliNissle 1917)可以減少了腫瘤的大小和重量。
Jun Li[5]發現腸道菌群組成向有益細菌(Prevotella and Oscillibacter)的轉移,以及這些細菌產生的抗炎介質,降低了腫瘤中Th17細胞的水平,從而限制了腫瘤的生長[6]。
三、糖尿病
HFD/STZ誘發糖尿病對腸道菌群有顯著轉變,其中可以降低Bacteroidetes和Proteobacteria,并且能夠增加Firmicutes[7]。Qian Zhang等[8]人發現Lachnospiraceae_UCG-005,Lachnospiraceae_UCG-010,Oscillibacter,Ruminococcaceae_UCG-010,Anaerovorax,Kurghia,Bilophila,和Anaerotruncus(P <0.01)等有關的屬與血糖水平升高有密切關系。

小結
由于大部分藥物都是通過口服給藥,腸道菌群會優先與藥物成分相互作用。所以了解腸道菌群的代謝與藥物治療疾病的過程尤其重要。從某種意義上,中藥是通過調節腸道菌群和人體的整體環境來治療疾病。無論是健康或者是病理狀態下人體生理代謝均受到腸道菌群結構變化的影響。通過建立相應的動物模型,實現體內菌群差異變化與體內內源性成分的關聯具有重要意義。了解此類機制,可能會開發出新的突破性治療方法,對闡明藥物的作用機制與物質基礎提供新的理論依據。
參考文獻
[1] Kau A L, Ahern P P, Griffin N W, et al. Human nutrition, the gut microbiome and the immune system[J]. Nature,2011,474(7351):327-336.
[2] Albenberg L G, Wu G D. Diet and the Intestinal Microbiome: Associations, Functions, and Implications for Health and Disease[J]. Gastroenterology,2014,146(6):1564-1572.
[3] Zheng H, Chen M, Li Y, et al. Modulation of Gut Microbiome Composition and Function in Experimental Colitis Treated with Sulfasalazine[J]. Frontiers in Microbiology,2017,8.
[4] Zhang H L, Yu L X, Yang W, et al. Profound impact of gut homeostasis on chemically-induced pro-tumorigenic inflammation and hepatocarcinogenesis in rats[J]. Journal of Hepatology,2012,57(4):803-812.
[5] Li J, Sung C Y J, Lee N, et al. Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice[J]. Proc Natl Acad U S A,2016,113(9):E1306.
[6] Yu, Le-Xing, Schwabe, et al. The gut microbiome and liver cancer: mechanisms and clinical translation[J]. Nature reviews. Gastroenterology & hepatology,2017.
[7] Hildebrandt M A, Hoffmann C, Sherrill Mix S A, et al. High-fat diet determines the composition of the murine gut microbiome independently of obesity.[J]. Gastroenterology,2009,137(5):1716-1724.
[8] Zhang Q, Xiao X, Li M, et al. Vildagliptin increases butyrate-producing bacteria in the gut of diabetic rats[J]. Plos One,2017,12(10):e184735.



