淺談--創(chuàng)新藥物申報(bào)
新藥(NewDrugs)是指化學(xué)結(jié)構(gòu)、藥品組分和藥理作用不同于現(xiàn)有藥品的藥物。根據(jù)《藥品管理法》以及2007年10月1日開始執(zhí)行的新《藥品注冊(cè)管理辦法》,新藥系指未曾在中國境內(nèi)上市銷售的藥品。對(duì)已上市藥品改變劑型、改變給藥途徑、增加新適應(yīng)癥的藥品,不屬于新藥,但藥品注冊(cè)按照新藥申請(qǐng)的程序申報(bào)。2015年對(duì)新藥的概念進(jìn)行了更改,新藥系指未曾在中國境內(nèi)外上市銷售的藥品。
新藥分類:化學(xué)藥物、天然藥物、生物技術(shù)藥物
新藥注冊(cè)的申報(bào)過程中需要資料包括:綜述資料、藥學(xué)研究資料、藥理毒理研究資料、臨床試驗(yàn)資料
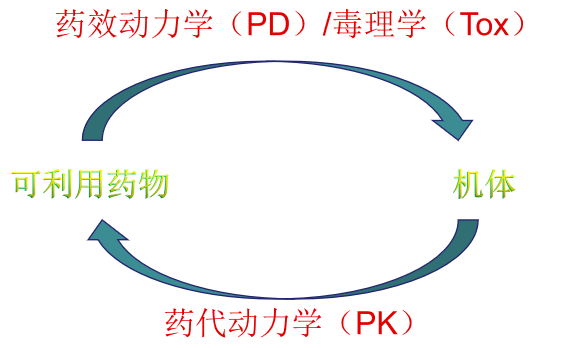
新藥申報(bào)過程中與藥理學(xué)、毒理學(xué)、藥代動(dòng)力學(xué)等相關(guān)學(xué)科研究具有重要意義。其中包括:
(1) 研究藥物、機(jī)體間相互作用的特點(diǎn)、規(guī)律與機(jī)制
(2) 研究藥物的暴露量與生物學(xué)行為之間關(guān)系
(3) 研究藥物在機(jī)體的作用下所發(fā)生的變化及其規(guī)律,包括藥物在體內(nèi)的吸收、分布、代謝和排泄過程,特別是血藥濃度隨時(shí)間變化的規(guī)律、影響藥物療效的因素等
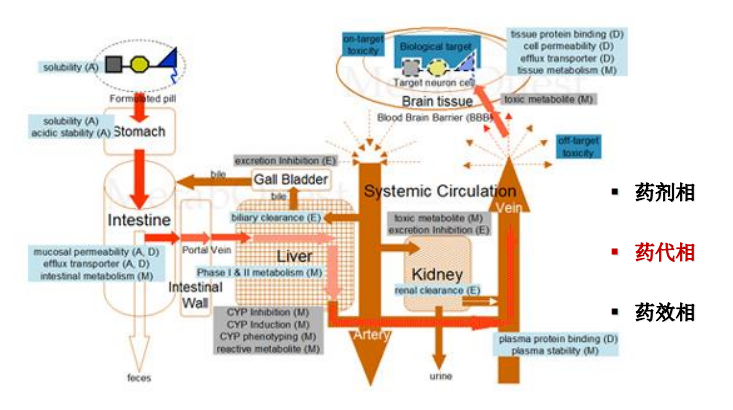
新藥注冊(cè)主要包括以下三大內(nèi)容:
支持新藥注冊(cè)的DMPK研究?jī)?nèi)容:
IND:IND主要目的是提供足夠信息來證明藥品在人體進(jìn)行試驗(yàn)是安全的,以及證明針對(duì)研究目的的臨床方案設(shè)計(jì)是合理的。
NDA:當(dāng)人體試驗(yàn)第三階段完成,所需非臨床試驗(yàn)已告結(jié)束,則可以出具一套資料,向FNS申請(qǐng)新藥上市許可之核準(zhǔn),NDA主要目的是確保上市藥品安全有效和質(zhì)量可控。
ANDA:ANDA的申請(qǐng)即為“復(fù)制”一個(gè)已被批準(zhǔn)上市的產(chǎn)品。其中,這里的“復(fù)制”是指其與該上市藥品具有相同的活性成分、劑型、規(guī)格、服用方式及適應(yīng)癥等。仿制藥申請(qǐng)被稱為簡(jiǎn)短的(abbreviated),是因?yàn)檫@類申請(qǐng)不需要提供臨床前(動(dòng)物)和臨床(人體)數(shù)據(jù)來證明其安全性和有效性。取而代之的是,仿制藥申請(qǐng)者必需提供產(chǎn)品生物等效性的證明材料(比如與原研藥相比沒有區(qū)別)。一旦此類藥品獲得批準(zhǔn),申請(qǐng)者可以生產(chǎn)并上市這一安全有效且價(jià)格低廉的替代物。
支持新藥注冊(cè)的DMPK法規(guī)要求:
? 藥品審評(píng)中心:
(1) 藥物非臨床藥代動(dòng)力學(xué)研究技術(shù)指導(dǎo)原則
(2) 化學(xué)藥物臨床藥代動(dòng)力學(xué)研究技術(shù)指導(dǎo)原則
(3) 化學(xué)藥物制劑人體生物利用度和生物等效性研究技術(shù)指導(dǎo)原則
(4) 藥物相互作用研究指導(dǎo)原則
(5) 化學(xué)藥物兒科人群藥代動(dòng)力學(xué)研究技術(shù)指導(dǎo)原則
(6) 藥物毒代動(dòng)力學(xué)研究技術(shù)指導(dǎo)原則
(7) 生物類似藥研發(fā)與評(píng)價(jià)技術(shù)指導(dǎo)原則(征求意見稿)
? 中國藥典:
(1) 生物樣品定量分析方法驗(yàn)證指導(dǎo)原則
(2) 藥物制劑人體生物利用度和生物等效性試驗(yàn)指導(dǎo)原則
支持新藥注冊(cè)的DMPK基本原則:
(1) 試驗(yàn)?zāi)康拿鞔_,體現(xiàn)藥物、劑型設(shè)計(jì)思路
(2) 試驗(yàn)設(shè)計(jì)合理
(3) 分析方法可靠
(4) 所得參數(shù)全面,滿足評(píng)價(jià)要求
(5) 對(duì)試驗(yàn)結(jié)果進(jìn)行綜合分析與評(píng)價(jià)
(6) 具體問題具體分析
小結(jié):
從事新藥安全性研究及申報(bào)要符合國家藥品監(jiān)督管理局《藥品非臨床研究質(zhì)量管理規(guī)范》(GLP)的相應(yīng)要求,實(shí)驗(yàn)動(dòng)物應(yīng)符合國家藥品監(jiān)督管理局的有關(guān)要求,以保證各項(xiàng)實(shí)驗(yàn)的科學(xué)性和實(shí)驗(yàn)結(jié)果的可靠性。



