藥物篩選工具系列1-分子互作親和力檢測
親和力是評價可逆反應過程中兩個分子間相互作用強弱的特征參數,是了解分子以及識別生物學過程、藥物的發現與篩選等的重要指標。蛋白質相互作用/親和力檢測可應用于藥物早期研究開發、篩選鑒定、臨床前與臨床研究以及下游生產質控等各個環節,而且在生命科學基礎研究、生物制藥開發等領域也有廣泛應用。目前業內常用的檢測技術有表面等離振子共振(Surfaceplasmonresonance,SPR)、Biacore分子互作系統、生物膜干涉技術(Bio-LayerInterferometry,BLI)、微量熱泳動(MST)系統、等溫滴定量熱(ITC)系統和圓二色光譜(CD)結構分析系統。
1、LSPR分子互作系統
親和力是判定分子間相互作用的重要參數,是了解分子以及藥物的發現與篩選等的重要指標,除了親和力之外,還有兩個對分子間相互作用評估至關重要的指標(Ka,Kd)。對于藥效的評價、生物大分子及其復合體的穩定性的評估需要從動力學、熱力學和熱穩定性等方面進行包括分子間的結合、結合的快慢、結合的強弱、結合的機理等多方面的全面性研究。
| 檢測項目 | 檢測內容 | 周期 |
| 蛋白樣品制備 | 蛋白/抗原/抗體 | 2-3周 |
| 分子間親和力定性 | 親和力報告(定性分析) | |
| 親和力測定 | 親和力報告(定量分析);結合常數(Ka)、解離常數(Kd)和親和常數(KD); 親和力強弱排序; |
基于LSPR平臺為生物醫藥研發、科研客戶提供相應的分子互作分析測試服務,能夠實現對蛋白,抗體、抗體片段、多肽、DNA/RNA、納米材料及小分子化合物等相互作用的定性定量分析,其次也可針對細胞裂解液、核酸文庫等依托LSPR-Selex技術垂釣篩選未知靶點。
檢測范圍:檢測范圍包括:蛋白-蛋白、抗體-抗原、蛋白-小分子、抗體-多肽、蛋白-DNA、DNA-DNA、蛋白-納米材料等分子間相互作用力檢測;除了蛋白、抗體外,細胞裂解液、細菌等也可結合LSPR-MS質譜等技術鑒定調控蛋白;也可在藥物篩選、醫療診斷、環境食品檢測、血液標志物檢測等領域有廣泛應用。 樣品要求: 2、Biacore分子互作系統 Biacore的檢測原理基于表面等離子共振技術(SPR),能夠靈敏地反映距離傳感芯片表面約150nm范圍內折光率的變化。為了研究兩個分子之間的相互作用,其中一個分子被固定到芯片表面上,而另一個分子以溶液的形式連續流過表面。檢測器能跟蹤檢測溶液中的分子與芯片表面的分子結合、解離整個過程的變化。SPR響應值直接與芯片表面附近的質量濃度變化成正比。 BIAcore系統可以為很多領域提供有價值的信息包括:動力學、親和力、特異性、熱力學和濃度等。Biacore系統原則上可以用于研究任何種類分子間的相互作用:從候選的有機藥物分子到蛋白質、核酸、糖、甚至是病毒和全細胞。因為響應值與質量濃度成正比,因此每摩爾濃度的結合分子產生的信號與其分子量成正比(較小的分子量產生較低的響應值)。現在分子量的實際檢測下限約為100Da(注:BiacoreT200對有機分子無分子量下限)。 Biacore的檢測原理不需要對任何樣品分子進行標記,既可以測定純化的樣品,也可以對復雜的混合物進行分析,比如細胞培養液上清,細胞裂解液。混合樣品的結合過程受樣品中結合反應物與固定在芯片表面的分子結合的特異性決定。SPR檢測技術無需改變分子性質,而且可檢測澄清、有色或不透明的樣品。 3、BLI生物膜干涉系統 ForteBio Octet分子相互作用分析系統是一種非標記的、實時監測的先進技術,主要用于生物分子間相互作用的全方位定量分析以及蛋白濃度測定。該平臺通過浸試即讀的檢測方式(DipandRead),可輕松處理未經純化的樣品,從而研究真實生物環境中樣品分子的相互作用和結合動力學,這類樣品通常無法在基于SPR的平臺上運行。如:分析未經過濾的細胞培養上清和裂解液;研究生物環境中分子之間相互作用;直接的病毒或病毒樣顆粒樣品親和力分析。 檢測原理 —生物膜干涉技術(Bio-LayerInterferometry,BLI) 生物膜干涉技術采用探針式生物傳感器對樣品直接進行檢測,對檢測樣品無需做任何熒光或同位素標記。通過儀器發射白光到傳感器表面并收集反射光,不同頻率的反射光譜受到生物傳感器的光膜層厚度的影響并形成干涉。因此,結合到傳感器表面的分子一旦有數量上的增減,光譜儀便會實時地檢測到干涉光譜的位移,而這種位移可直接反映出傳感器表面生物膜的厚度及密度變化,從而對待測分子間的相互作用過程進行精確的定量測定。 4、微量熱泳動(MST)系統 提供MonolithNT.115微泳動量熱生物分子相互作用檢測服務項目。微量熱泳動(MicroScaleThermophoresis,MST)是一種定量分析生物分子間相互作用的前沿技術,通過精確檢測熒光變化,結合靈敏的熱泳動現象,MST提供了一種靈活、強大和快速測量分子間相互作用的方法。MST測試時,由紅外激光建立微觀溫度梯度場,通過熒光染料標記、熒光融合蛋白、色氨酸自發熒光等信號追蹤,分子在微觀溫度梯度場中的定向移動就可以被探測和量化。MST在緩沖液中操作,無需任何表面固定,因此即使對于體積較大、不穩定的樣品,比如脂質體、納米材料或者膜蛋白,也同樣適用。MST將熒光檢測的精準性與熱泳動的靈活性及靈敏度結合起來,快速、可信地檢測分子間相互作用。MST可用于檢測小分子之間、蛋白和蛋白之間、多蛋白復合物之間的相互作用,應用范圍廣泛。 5、等溫滴定量熱(ITC)系統 等溫滴定量熱系統提供MonolithNT.115微泳動量熱生物分子相互作用檢測服務項目。微量熱泳動(MicroScaleThermophoresis,MST),通過精確檢測熒光變化,結合靈敏的熱泳動現象,MST提供了一種靈活、強大和快速測量分子間相互作用的方法。 等溫滴定量熱法(ITC)是用于量化研究各種生物分子相互作用的一種技術,可以測定結合配偶體在自然狀態下的親和力,無需通過熒光標記或固定化技術對結合配偶體進行修飾。通過測量結合過程中的熱傳遞,就能夠準確地確定結合常數(KD)、反應化學量(n)、焓(?H)和熵(ΔS)。這就提供了有關分子相互作用的完整熱力學信息。ITC不僅可測定結合親和力,還能闡明潛在分子相互作用的機制。 測量原理: 工作原理: 進行測量:參比池和樣品池被設定到所需的實驗溫度。將配體裝入一個非常精確的注射裝置上的注射器中。將注射裝置插入包含目標蛋白質的樣品池中。將一系列小份配體試樣注入到蛋白質溶液中。如果有配體與蛋白質結合,則可檢測到并測出幾百萬分之一攝氏度的熱量變化。進行第一次注射時,微量熱計測量被釋放的所有熱量,直到結合反應達到平衡。測得的熱量與結合量成正比。 結果和數據分析: 示例中,反應是放熱的,意味著樣品池溫度高于參比池并由此導致信號出現下行波峰。隨著兩個池的溫度恢復到同一水平,信號也回到其起點。將第二小份配體試樣注入到樣品池中,同樣,微量熱計補償所檢測到小幅熱量變化。配體與蛋白質之間的摩爾比隨著一系列配體試樣的注入而逐漸增加。蛋白質越來越飽和,配體結合的次數越來越少,并且熱量變化開始減小,直到樣品池中的配體數量相對于蛋白質而言最終表現出過量為止,從而使反應朝飽和的方向進行。 然后對每個峰的面積進行積分,并以配體與蛋白質的摩爾比作為橫坐標進行繪圖。由此得出的等溫線可擬合至導出親和力(KD)的結合模型。結合等溫線中心的摩爾比即為反應化學計量。下圖給出了1:1結合反應的示例圖。 焓(ΔH)也可通過等溫線直接導出,它表示每摩爾結合配體所釋放的熱量。這就意味著一次ITC實驗就可提供豐富的結合反應信息,有助于理解相互作用的性質并探索熱力學驅動因素。 6、圓二色光譜(CD)結構分析系統 利用蛋白質的圓二色性及不對稱分子對左右圓偏振光吸收的不同來進行結構分析。圓二色譜在遠紫外區的掃描圖譜,反映的是蛋白質肽鍵的排布信息,計算所得的是蛋白質二級結構比例,即α-螺旋、β旋折疊、轉角和不規則卷曲的比例;圓二色譜在近紫外區的掃描圖譜,反映的是蛋白質側鏈生色基團色氨酸、苯丙氨酸、酪氨酸等殘基的排布信息和二硫鍵微環境的變化。 基本流程: 客戶提供: 提供樣品: 遠紫外:濃度>0.5mg/ml,樣本量>200μg,純度>90%;
1配體蛋白(標記芯片)
1.1、純度大于90%
1.2、濃度大于0.1ug/ul(盡可能高),提供10ug左右。
1.3、需提供配體蛋白的等電點
1.4、配體蛋白緩沖液盡量避免Tris等帶有氨基基團的試劑
1.5、避免顆粒或絮狀沉淀
2、分析物(流動相)
2.1、純度大于80%
2.2、濃度大于0.1ug/ul(盡可能高),提供凍干粉最好。根據樣本情況,提供10-100ug左右。
2.3、提供準確分子量和濃度以及溶劑成分
2.4、溶劑最好不能含有有機化合物,如:DMSO甘油。如果一定需要加入有機溶劑,就盡量提供高濃度的分析物,通過稀釋可以降低其含量比。
2.5、盡可能不含有海藻糖,BSA,蔗糖等保護劑。如果一定需要加入,需提供準確的濃度,以及盡可能提供高濃度含分析物原液,以便通過稀釋降低其含量比,稀釋后上樣終濃度中抗原抗體保護劑濃度≦0.01%既可。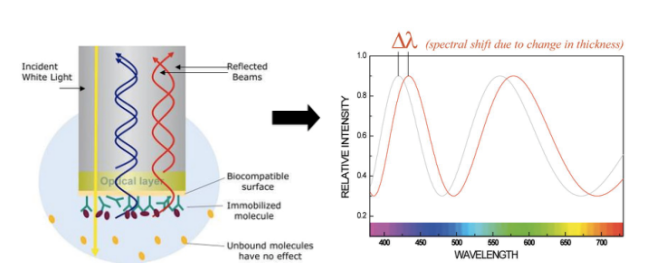
等溫滴定量熱法用來測定各生物分子之間的反應。該方法可測定結合親和力、化學計量以及溶液中結合反應的熵和焓,無需使用標記。
熱核心:微量熱計中有兩個池,其中一個含有水,作為參比池,另一個含有樣品。微量熱計必須使這兩個池保持完全相同的溫度。熱敏裝置檢測發生結合時兩個池之間的溫差,并反饋給加熱器,由加熱器來補償該溫差并使兩個池恢復到相同的溫度。


近紫外:濃度>5mg/ml,樣本量>2mg,純度>90%;
不要添加任何保護劑或其他物質(透明性極好的磷酸鹽可用作緩沖體系)
提供信息:
樣品制備方法及緩沖液信息、純度檢測方法及結果圖譜數據;
樣品如被修飾,請詳細告知修飾方法。



